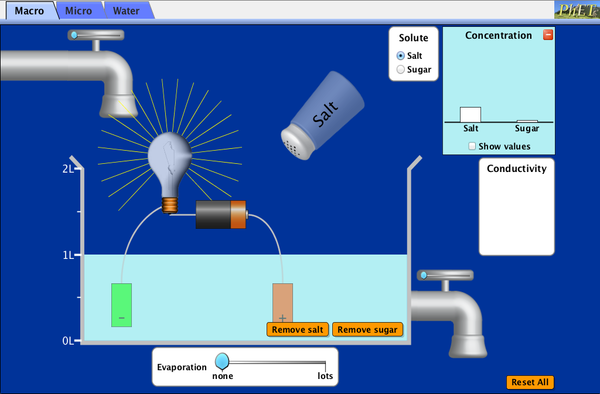
Πείραμα: Αγωγιμότητα διαλύματος αλατιού
 |
| Το λαμπάκι μας ανάβει όταν προσθέτουμε αλάτι. |
Υλικά για το πείραμα
λίγο αλάτι
1 ποτήρι
1 μπαταρία 4,5 Volt
αλουμινόχαρτο
καλώδιο
ψαλίδι
μονωτική ταινία
1 χάλκινο κέρμα
Βήματα
1. Φτιάχνουμε ένα απλό κύκλωμα με μία μπαταρία και αλουμινόχαρτο όπως φαίνεται παρακάτω. Ακουμπάμε τα αλουμινόχαρτα μεταξύ τους. Τι παρατηρούμε; Γιατί γίνεται αυτό;
2. Τοποθετούμε τα δύο αλουμινόχαρτα μέσα στο νερό. Τι παρατηρούμε;
3. Προσθέτουμε σιγά σιγά αλάτι μέσα στο νερό. Τι παρατηρούμε; Γιατί γίνεται αυτό;
Ποτε αρχίζει να ανάβει το λαμπάκι; Τι μπορουμε να κάνουμε
Τι γινεται αν ανακατέψουμε το διάλυμα;
Τι γινεται αν βαλουμε ζάχαρι αντί για αλάτι;
Αρχικά το λαμπάκι μας δεν ανάβει όταν τα αλουμινόχαρτα δεν ακουμπούν το ένα το άλλο. Όταν όμως αρχίσουμε και προσθέτουμε αλάτι ο λαμπτήρας αρχικά φωτοβολεί λίγο και στη συνέχεια περισσότερο.
 |
| Ρίξαμε κέρμα μέσα στο νερό και αυτό έγινε πράσινο!! |
Τι παρατηρούμε μέσα στο νερό; Γιατί δημιουργούνται φυσαλίδες; Τι χρώμα γίνεται το νερό;
 |
| Μετά από αρκετό χρόνο το χρώμα του νερού έγινε πράσινο!! |
4. Προσθέτουμε μέσα στο νερό ένα κέρμα και το αφήνουμε για 2 λεπτά. Τι χρώμα γίνεται το κέρμα; Γιατί γίνεται αυτό;
και λίγη περισσότερη φυσική....
Μελετάμε την αγωγιμότητα του διαλύματος άλατος.
Η ηλεκτρική αγωγιμότητα διαλύματος είναι μια μαθηματική έκφραση της ικανότητας ενός υδατικού διαλύματος να άγει το ηλεκτρικό ρεύμα. Η ικανότητα αυτή εξαρτάται από την παρουσία ιόντων, το σθένος τους, την κινητικότητα τους, τη συγκέντρωση τους, τη θερμοκρασία, το ιξώδες του διαλύματος και το μέγεθος της διαφοράς δυναμικού με την οποία γίνεται η μέτρηση. Τα διαλύματα των περισσότερων ανόργανων οξέων και βάσεων και όλων των αλάτων είναι σχετικά καλοί αγωγοί του ρεύματος. Αντίθετα τα μόρια των οργανικών ενώσεων, που δεν διίστανται όταν διαλυθούν στο νερό, άγουν ελάχιστα ή καθόλου το ηλεκτρικό ρεύμα.
Ηλεκτρόλυση (λύση δι΄ ηλεκτρισμού), ονομάζεται η διαδικασία της διάσπασης μιας ουσίας με τη βοήθεια του ηλεκτρικού ρεύματος.
- Η ηλεκτρόλυση αξιοποιείται ειδικά τόσο στην εξαγωγή καθαρών μετάλλων από τα μεταλλεύματά τους, όσο και στις επιμεταλλώσεις.
- Η ηλεκτρόλυση θεωρείται ειδική χημική αντίδραση και αποτελεί αντικείμενο έρευνας και μελέτης της Ηλεκτροχημείας.
Διάρκεια πειράματος: 10 λεπτά
Βαθμός δυσκολίας: 2/5
Εφαρμογή: Φυσική Στ΄Δημοτικού Ηλεκτρισμός Χημεία Γ΄ Γυμνασίου Ηλεκτροχημεία Χημεία Β' Λυκείου Ηλεκτροχημεία
Κείμενο- φωτογραφίες: Τίνα Νάντσου
Πηγή θεωρίας : Wikipedia













τελειο
ΑπάντησηΔιαγραφή